Пероксид водорода |
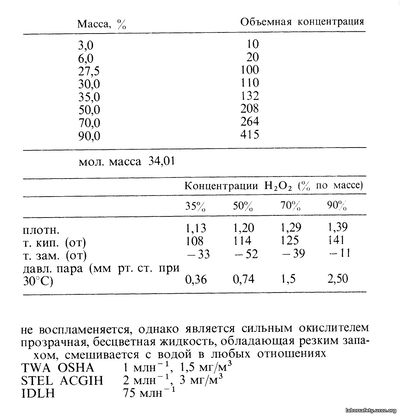
Пероксид водорода находит широкое применение в самых различных областях благодаря его сильным окисляющим и отбеливающим свойствам. Он также используется как реагент при синтезе различных химических соединений. Пероксид водорода поступает в продажу в виде водных растворов; как правило, используются 35, 50 (промышленная концентрация), 70 и 90% (концентрированные растворы) по массе, имеются также 3, 6, 27,5 и 30%-ные растворы. Пероксид водорода, кроме того, продается в соответствии с «объемной концентрацией» (количество выделяющегося газообразного кислорода из 1 мл раствора). В приводимой ниже таблице сопоставляются процент по массе и объемная концентрация. В процессе производства пероксид водорода стабилизируют, с тем чтобы избежать загрязнения металлами и другими примесями, однако при высокой степени загрязнения стабилизирующие добавки не препятствуют разложению. Медленное разложение происходит, даже если соединение стабилизировано, поэтому пероксид водорода необходимо хранить в чистом виде (без примесей) в контейнерах, оборудованных дыхательными клапанами. Концентрированные растворы пероксида водорода являются чрезвычайно высокоэнергетическими веществами. При разложении пероксида с образованием кислорода и воды выделяется большое количество тепла, что приводит к увеличению скорости разложения, которая возрастает с повышением температуры. В интервале температур между 20 и 100°С скорость разложения увеличивается в 2,2 раза на каждые 10°С. Чистые растворы пероксида водорода при атмосферном давлении, как правило, не взрывоопасны, однако равновесные концентрации пара пероксида водорода выше 26% молярных (40% по массе) становятся взрывоопасными при температурах, не превышающих температуру кипения жидкости. Поскольку пероксид водорода является сильным окислителем, то при попадании брызг этого вещества на горючие материалы возможно возникновение пожара. При смешивании пероксида с несовместимыми жидкостями (а ими являются большинство органических растворителей) может происходить детонация. Растворы пероксида водорода, концентрации которых менее 45%, при охлаждении расширяются, а растворы, имеющие концентрацию более 65%, сжимаются. Производство. Наиболее важный процесс получения пероксида водорода заключается в восстановлении (гидрировании) алкилантрахинонов до соответствующих антрагидрохинонов, которые затем окисляют с выделением пероксида водорода и исходного алкилантрахинона, поступающего на рециркуляцию. Другой метод производства, применяемый на небольших предприятиях, состоит в электролизе растворов гидросульфатов. Это приводит к образованию персульфатов, которые затем гидролизуются с выделением пероксида водорода и исходного сульфата. Рекомендуется использовать в этом процессе раствор гидросульфатаммония. Одна из химических фирм в США применяет изопропиловый спирт и кислород для производства ацетона и пероксида водорода. Этот процесс перестали использовать в середине 80-х гг. Известны также другие способы получения: взаимодействие минеральных кислот с пероксидом бария, гидролиз органических надкислот, самоокисление различных углеводородов, а также прямое соединение водорода и кислорода. Применение. В зависимости от концентрации растворы пероксида водорода находят различное применение: 27,5%-ные растворы когда-то использовались в коммерческих целях, 3 и 6%-ные растворы применяются в медицине и косметике, 30%-ные в качестве лабораторного реактива, 35 и 50%-ные во многих промышленных производствах, 70%-ные, как органический окислитель, 90%-ные растворы в некоторых производственных процессах, а также в качестве реактивного топлива. Самое большое применение пероксид водорода находит при производстве химических веществ: неорганических пероксидов, глицерина, пластификаторов, органических пероксидов, лекарственных и косметических препаратов, ускорителей сушки жиров, масел, парафинов, оксидов аминов. Пероксид водорода используется в текстильной промышленности для отбеливания тканей, особенно хлопка, в целлюлозно-бумажной промышленности для отбеливания древесной целлюлозы, в горном деле для растворения урана в выщелачивающих растворах, в электронной промышленности при травлении и окислении, а также при обработке поверхностей металлов. Пероксид водорода вызывает разложение некоторых соединений, устойчивых к другим веществам, поэтому он в последнее время широко применяется для очистки сточных вод, заменяя хлор, который может образовывать токсичные вещества. Главное преимущество пероксида водорода состоит в способности превращать сероводород в элементарную серу и воду. Это свойство также позволяет употреблять пероксид для удаления сероводорода из пара на геотермальных теплоэлектростанциях. Эта новая область использования пероксида водорода может расшириться с ростом числа и мощности геотермальных станций. Другие области применения пероксида водорода связаны с его окисляющими и отбеливающими свойствами. Это касается его употребления для производства косметических средств, в качестве антисептика и при дезинфекции, при обработке пищевых продуктов и вина, при очистке реактивного топлива, газа, масла и дерева. |
|
|

|

|